PRRSV继续进化,在时间和地理空间上形成不同毒株的集群。影响美国的最新“高致病性”PRRSV毒株具有RFLP模式1-4-4,是Lineage 1 C中的一种特殊变体(以下简称L1Cv)。
重要的问题是这些病毒来自哪里?它们如何在养猪业中迅速传播?理解这些可以让我们转向下一个合乎逻辑的问题:“我们如何停止这个循环?”

猪病报告系统反复证明,(来自生长育成场的PRRSV PCR样本的阳性率比来自母猪场的样本高20至30个百分点 图1)。此外,SDRS数据报告显示,生长育成场的PRRSV PCR阳性率的季节性峰值先于母猪场样本(这种现象也见于肠道冠状病毒和甲型流感病毒检测)。

乍一看,这似乎违反直觉,因为大多数猪都是从母猪场流向生长育成场,而不是从生长育成场到母猪场。为什么我们看到生长育成猪的阳性率较高,为什么在母猪养殖场之前,生长肥育猪的PRRSV检测出现上升?部分原因是,许多母猪场都进行了常规监测,以确认控制状态或进展,因此许多样本PCR呈阴性并不奇怪。然而,到目前为止,生长猪监测是由疾病的临床表现推动的。Magalhaes等人(2021)报告称,提交样本进行诊断测试与生长育成累积死亡率增加相关。换言之,患有呼吸道疾病(即PRRSV感染)的生长猪群更有可能提交样本进行检测,从而影响数据以代表受影响猪群(而非一般猪群)中 PRRSV 的活动。
更重要的是,众所周知,生长育成猪群的生物安全水平(仍然)低于母猪群。例如,员工在进入猪场和走出猪场时进行淋浴的情况并不常见,每次装载动物后对拖车进行清洗消毒也不常见。此外,并非所有生长猪群都进行PRRSV免疫接种。总的来说,这些因素为病毒在生长育成场之间的循环、出现和传播创造了巨大的机会,增加了该地区以及具有运营联系的猪场之间的总体感染压力(例如,共享员工、用品、卡车)。田间PRRSV(和其他病原体)的高“负荷”转化为母猪场的暴露和爆发,保持传播周期持续活跃。
回到L1Cv的例子,用美国兽医诊断实验室的数据总结的流行病学曲线显示了3波检测,其中第一波主要由生长育成猪的检测驱动。第二波母猪场的参与率较高,但直到第三波,大量母猪场才报告了L1Cv活动(图2)。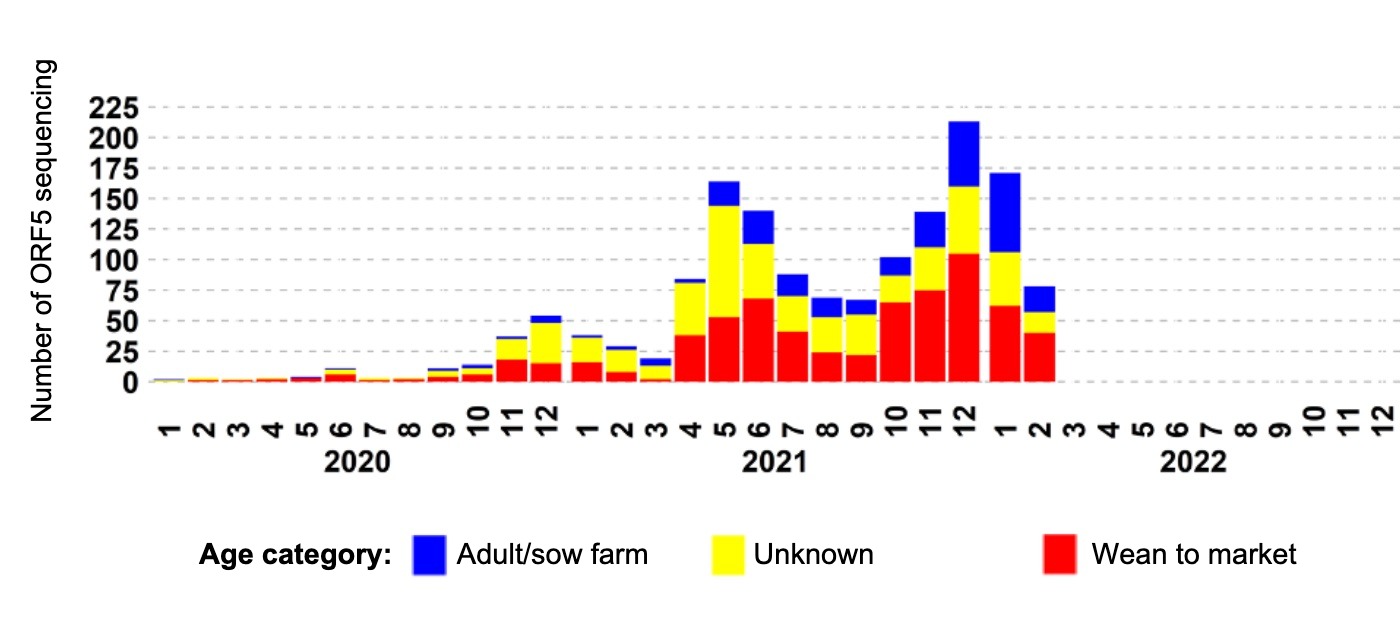
我们该怎么办?
到目前为止,我们强调了生长育成猪群作为PRRSV重要来源的重要性。相对于母猪场,生猪存栏众多,缺乏对病毒的杀菌免疫力,以及养殖场之间的频繁联系,使生长育成猪成为病毒活动的热点,从而产生新的病毒拷贝,这些病毒将继续寻找新的猪场感染。那么,我们该怎么办?行业能做些什么来影响这一系列事件?
简短回答=生物安全和生物防护。
我们认为,该行业是时候加快步伐,提高生长育成猪的生物安全和生物控制标准了,类似于目前仍在母猪场进行的工作。很难想象一个养猪业会有比今天更少的猪流动量,但有一些策略可以显著帮助降低病毒传播。
规定具体的生物安全指南超出了本文的范围。然而,我们相信在生猪育成猪场员工间传达生物安全的重要性。人们倾向于更好地遵守他们了解其重要性的活动和程序。在制定新的生物安全规则之前,我们需要回到基础上来,实施我们知道有效的做法(例如,淋浴或换衣服)。
另一种降低生长期感染压力的可行方案是更好地利用免疫工具。有充分的证据表明,疫苗接种计划显著减少了野生型PRRSV在各日龄阶段猪群中的传播。生产系统和兽医诊所应在学术机构的帮助下,与制药公司合作,在区域协调项目中展示此类做法的经济优势。最近一个很好的例子是匈牙利成功地根除了野生型病毒,这主要是通过诊断测试和免疫来完成的。荷兰和丹麦目前正在评估国家控制/根除项目。
回到生产系统和兽医诊所,我们相信他们希望减少疫情爆发次数,减少PRRSV遗传多样性(野生型菌株数量)在畜群中传播。需要思考的一个问题是“你能在你的生产系统或地区做些什么来降低生长猪中野生型PRRSV感染的压力”?我们都会为您提供帮助。不要在继续等待!
333 team



