经过多年的发展,PRRS诊断已形成几种有价值的测试方法。要采样的动物类型和采样过程的性质取决于测试的目的:我们应该测试母猪、仔猪、育肥猪还是所有这些动物?;我们是对猪群进行有针对性的抽样还是随机抽样?;我们的样本量应该是多少?我们还需要决定样本的类型:我们是采集血清、组织、口腔液体还是精液?最后,我们不能忘记采样时与疾病阶段有关的所有问题。临床症状何时出现,我们是否希望诊断测试能够检测病毒,识别病变或检测抗体?最后,至关重要的是我们了解每种诊断测试的优缺点。
了解不同诊断方法并为我们需要完成PRRS采样的不同目的选择正确的诊断策略,可提高猪群健康管理计划的有效性。

完成PRRS采样的场景
当阴性或PRRS稳定的猪场出现潜在PRRS爆发的症状时,常用于疾病调查。在这种情况下,由兽医进行测试,以了解临床症状的原因和引起问题的病原体的来源。另一种常见的情况是监测阳性和PPRRS不稳定猪群中是否存在PPRRS,该猪群已经采取了控制或根除策略,并希望了解其进展情况。最后,PRRS检测在疾病监测中非常常见。在最后一种情况下,测试在阴性猪场进行,通常需要更多的样本,以便最大限度地提高猪群无PRRS状况的可信度。
我们的诊断目标指导我们的测试选择
我们将PRRS诊断试验分为三种类型:
-
检测病变:尸检观察和组织病理学,只能在实验室显微镜下进行。病变检测试验最常用于临床症状明显的PRRS暴发早期;
-
检测病毒的方法:聚合酶链反应(PCR),病毒分离(VI)和免疫组织化学(IHC)测试。病毒检测是用于早期确认病毒存在的最可靠的诊断工具。
- 检测抗体的试剂:酶联免疫吸附测定(ELISA),免疫过氧化物酶单层测定(IPMA)和间接免疫荧光测定(IFA)。 对PRRSV接触的免疫学确认需要更长的检测时间,但在无法检测到病毒时确认暴露。
测试特性决定了测试的值
考虑进行任何测试时,复查诊断测试的灵敏度(SE)和特异性(SP)非常重要。了解此信息有助于正确解释可能的结果并采取相应措施。
-
灵敏度是一种诊断测试的能力,能够正确识别真正阳性的样本。灵敏度低的测试会产生太多假阴性结果。
-
特异性是诊断测试正确识别真实阴性样品的能力。特异性较低的测试会产生太多的假阳性结果。
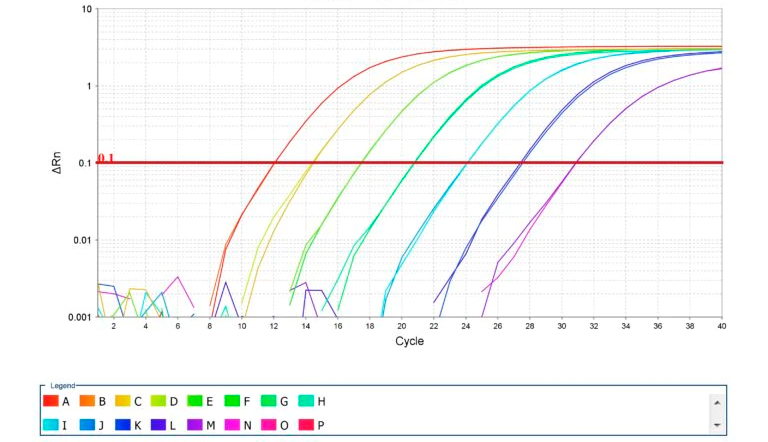
PRRS的诊断选项
表1汇总了所有方案和诊断选项。
1. 暴发调查:对于发生疾病暴发的猪场,诊断方案的目标是确认感染,并在可能的情况下,对该菌株进行基因鉴定。早期兽医介入有助于有效实现这些目标。如果存在典型临床症状的猪,强烈建议对这些动物进行有针对性的取样,以寻找肉眼可见的病变。在现场鉴别出特征性病变(即重度、无塌陷、有大理石样外观的肺)后,应进行PCR和组织病理学检查以确认诊断。应完成基因测序以鉴定该毒株。测序是通过与其他已知毒株的比较了解潜在新病毒的流行病学(即原先的、常驻的或新出现的)的关键。

2. 疾病监测:在PRRSV阳性猪场中,为了最大程度地减少由于生产不稳定造成疾病的负面影响,应尽快实施控制计划(有时根除)以生产阴性仔猪。在这种情况下,诊断程序的目的是证明表明PRRS稳定性的关键参数(即后备母猪驯化,种猪群免疫力和阴性仔猪的生产)。血清学用于确定良好的后备母猪和种猪群暴露,PCR用于确定新生和断奶仔猪中不存在该病毒。在这些条件下,我们会使用敏感性较高的测试(即尽可能少的假阴性)。因为我们正在与一个PRRS阳性仔猪的预期患病率可能很低或没有的猪场打交道,所以需要大量样本才能准确地确认PRRS的状况。假设仔猪未受到临床影响,猪场内随机选择的仔猪和新引入的阴性母猪是我们采样的最佳目标猪群。大多数样本类型(即血清,口腔液体,处理液和组织)都是有价值的,但在评估结果时了解测试之间的敏感性和特异性差异很重要。在可能的情况下,应始终考虑合并,以降低分析成本。
3. 疾病监测:在阴性猪场进行疾病监测时,我们通常会选择特异性最高(即假阳性结果最少)的测试。这些猪场(即授精中心或扩繁场)在大多数情况下都需要定期记录其状态。就母猪场而言,ELISA试验是证明不存在PRRS暴露的最佳选择。其价格低廉,速度快,具有良好的敏感性和特异性。这些猪场通常会进行二次血清学检测,以确定其意外阳性结果(通常占总样本的1-2%)是真阳性还是假阳性。间接荧光抗体试验(IFA)或免疫过氧化物酶单层试验(IPMA)都是以预先制备的感染单层细胞的间接染色为基础的,可作为ELISA意外阳性的常见验证性测试。PCR作为一种早期检测方法,可用于:1)后备母猪分娩前的口腔液体;2)授精中心公猪的血清或血样。
总之,在正确的时间,正确的动物身上选择正确的测试,并正确地解释它们,将提高PRRS诊断策略的速度、准确性和成本效益。
表1:诊断方案和策略总结
爆发调查
- 猪场PRRS状态
-
不稳定
-
病毒的主动传播
-
新PRRS的引入
-
疾病流行率高
-
- 诊断目的
-
检测感染
-
鉴定PRRSV病毒毒株
-
- 动物
-
出现临床症状的动物
-
死胎
-
- 样本类型
-
目标样本
-
少数动物
-
综合样本
-
- 样本
-
组织
-
血清
-
- 主要诊断选择
-
尸检以确定病变
- 优点
-
快速
-
现场可操作
-
便宜
-
- 缺点
-
敏感性/特异性低
-
-
- 辅助诊断选项
- PCR/病毒测序检测 /鉴定PRRSV毒株n
- 优点
-
敏感性/特异性高
-
快速,24小时
-
结果可以量化 (RT-qPCR)
-
- 缺点
-
交叉污染可能导致假阳性:确保良好的样品管理(采样和处理期间)
-
疾病监测
- 猪场PRRS状况
-
稳定
-
长期存在
-
疾病流行率低
-
- 诊断目的
-
监控稳定性/控制
-
监测根除计划
-
- 动物
-
Piglets (newborn and weaned) 仔猪(新生和断奶)
-
后备母猪
-
- 样本类型
-
随机抽样/动物数量多
-
目标采样/动物数量少
-
综合样本
-
- 样本
-
口腔液体
-
血清
-
处理液
-
仔猪舌头液体
-
- 主要诊断选项
-
PCR检测感染后约7天后的抗原(RNA)
- 优点
-
敏感性/特异性高
-
快速,24小时
-
结果可以量化 (RT-qPCR)
-
- 缺点
-
交叉污染可能导致假阳性:确保良好的样品管理(在采样和处理过程中)
-
-
- 辅助/替代诊断选择
-
ELISA从感染后约14天开始检测抗体(IgM,IgG,N)
- 优点
-
每个样本成本低
-
2-4天出结果
-
确认实验室没有病毒暴露史
-
- 缺点
-
特异性低
-
无法区分疫苗和田间病毒暴露
-
结果无法量化
-
-
疾病监测
- 猪场PRRS状况
-
PRRS阴性猪场
-
- 诊断目的
-
确保阴性状态
-
-
动物
 |
|
4. 样本类型
|
4. 样本类型
|
|
5. 样本
|
5. 样本
|
|
6a. 主要诊断选择(母猪,后备母猪和仔猪)
6b. 主要诊断选择(母猪,后备母猪和仔猪)
7. 辅助诊断选择
|
6. 主要诊断选择
|
来源:pig333



