背景
在过去几年中,采样和诊断技术的改进使得猪场采样更加容易,如使用血液汇集技术和口腔液体。然而,兽医和生产者一直在寻找更灵敏,更便宜,更快速的猪群采样技术。实现这些目标的方法之一是通过常规操作,例如仔猪阉割和断尾,这是母猪场常规操作程序的一部分。我们建议使用处理液(PF),其是工作人员在常规断尾和阉割时,在桶底积聚的液体。本研究旨在通过实时PCR评估处理液的准确性,以评估母猪群中的猪繁殖与呼吸综合征病毒(PRRSV)状态。

材料和方法
在一个暂定阴性的猪场爆发疫情后进行采样。在连续8周期间,每周选择不同胎次的10窝仔猪,在断尾和阉割(3日龄)时采集样本。窝次的选择应能在空间上表征猪舍和胎次。对所选全部仔猪进行放血和检测,以将其用作金标准比较样本。同一窝仔猪的睾丸和尾巴放在同一个Ziplock袋中。这些组织在袋中保存至少两小时。然后用无菌移液管取出液体并置于无菌血清管中。血液和处理液都在猪场离心分离,并在冷藏条件下运送到实验室。所有样品均采用实时RT-PCR检测。
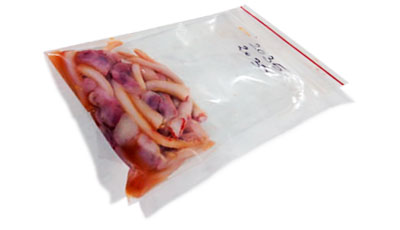
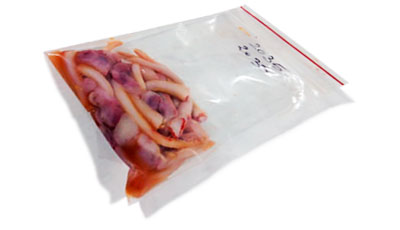
图1.用Ziplock袋收集的尾巴和睾丸
结果和讨论
构建了比较血清状态和处理液状态的2x2(表1)表格。如果其中至少有1头仔猪血清呈阳性,则认为该窝呈阳性。根据CT阴性阈值低于37.5,而不是传统的40对阳性进行分类,以便将CT值在可疑范围内(35-40)的样本包括在分析中。该方法的灵敏度(95%置信区间)和特异性(95%置信区间)分别为83%(63-95%)和92%(82-98%)。 两种类型样本间的一致性良好(Kappa:0.76(95%置信区间:0.53-0.98%))。检测到4个假阳性和4个假阴性。假阴性仔猪的血清具有低病毒载量(高Ct值),当稀释时,这些样本的Ct值降为负数。尽管极为小心地转移处理液,也可能出现交叉污染,因我们观察到4个假阳性结果。
当比较低胎次组(第一和第二胎)与高胎次组(超过第二个胎)时,阳性处理液百分比间存在统计学差异(p <0.05),低胎次组的阳性率较高。这与Cano等人(2008)的观点一致。他们在试图确定与PCR阳性仔猪检测率较高相关的风险指标时发现了这一现象。
只要有一头仔猪呈阳性,则处理液显示为阳性,表明处理液是一种非常灵敏的样本,可以通过它了解仔猪群的状况,从而了解猪群的整体状况。同时,这些结果强调了收集睾丸和尾巴在减少疾病的传播中的重要性。此外,可以从处理液样本中分离蓝耳病病毒,并对其进行测序。
该研究的一个局限性是它仅代表采样猪场的情况。
当然,该技术仅能在允许阉割和断尾的国家使用。在动物福利法建议使用灼烧断尾的地区,需要进一步研究以阐明使用该样本作为诊断工具的可能性。
表1:使用血清作为黄金标准的窝次状态的2x2表。
|
窝次情况(血清)  |
|||
| + | - | ||
| 处理液情况 | + | 20 | 4 |
| - | 4 | 49 | |
结论
即使在爆发后的一段时间内(约6个月),处理液都是检测仔猪蓝耳病病毒的有效样本,尤其是产自低胎次母猪的仔猪。此外,应将睾丸和尾巴收集在一个桶中,因其是产房中蓝耳病病毒的潜在传播载体。
来源:pig333