使用最广泛的2种检测PRRS的诊断方法:酶联免疫吸附试验和聚合酶链反应。在该篇文章中,我们将重点讨论聚合酶链反应,这种方法可以检测几乎任何样本中的病毒。它依赖于循环DNA的DNA聚合,或者像在PRRS的情况下,在每个PCR周期,两侧为短序列的cDNA片段与特定的DNA引物结合。采用聚合酶链反应诊断方法的敏感性和特异性取决于这些引物对其目标的适合度以及用于循环扩增的热循环。理想情况下,它们应仅与特定病毒的基因组互补,不能与任何其他微生物或宿主DNA序列结合,但仍能够检测所有菌株的基因组或该病毒的变体。故其针对基因组中最保守的片段。
开发具有高灵敏度和特异性的蓝耳病毒PCR检测方法是最具挑战的任务之一。目前已知的PRRS病毒有两种,PRRSV-1和PRRSV-2。2种PRRSV均在全球广泛存在,但PRRSV-1在欧洲占主导地位,而PRRSV-2在美国和亚洲占主导地位。可以认为主要PRRSV亚型的遗传多样性高于具有较低流行性的亚型。实际上,在欧洲或美国使用的聚合酶链反应分析可能更有效,也更适合检测PRRSV-1或PRRSV-2。因此,在特定区域的一些“次要”菌株型仍可能未被发现,低估了其在PRRS发病机制中的作用。在PRRSV-1和PRRSV-2共同传播的猪场,这一点尤其重要。PRRS病毒的遗传多样性需要不断更新PCR引物和探针的序列,以跟踪病毒的不断进化和发现全新的遗传变异。这一点尤其适用于具有高度遗传多样性的PRRSV -1,来自俄罗斯、白俄罗斯和乌克兰的参考病毒的低可用性对商品PCR试剂盒对PRRS -1的东欧遗传亚型的敏感性造成威胁。

目前,实时PCR变体主要用于常规诊断。几种实时PCR方法的原理不同,但最广泛使用的是所谓的TaqMan探针法。Taqman探针是一个用荧光团标记的短DNA片段(寡核苷酸),它在侧翼引物间结合靶向DNA。如果发生结合,则在DNA聚合期间裂解探针并通过PCR仪器记录荧光。实时PCR特别适用于诊断目标的多重化。这意味着在单个PCR反应(或单个测试)中,可以通过2-3种不同染料的荧光来检测2-3种不同的病原体。故可很容易地同时检测两种PRRSV型,并在来自个体动物,猪栏或猪场的样品中进行区分。
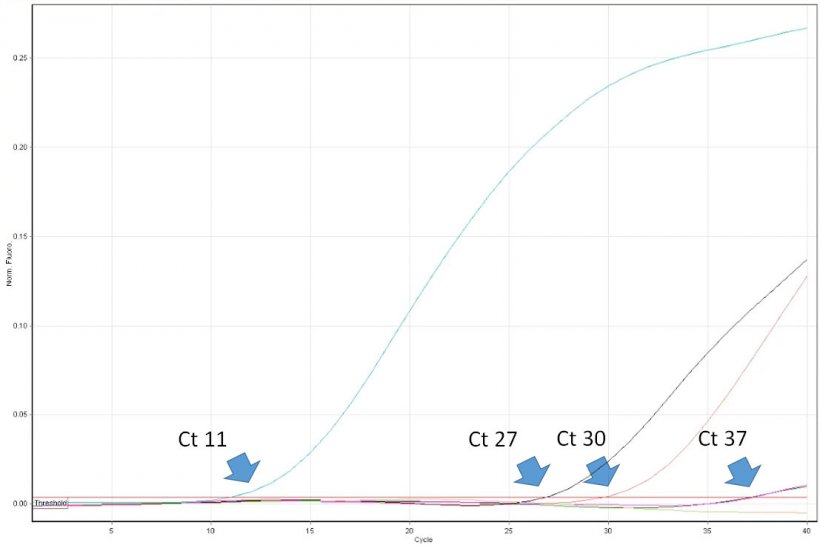
图1。阈值循环数(CT)是检测到荧光时实时PCR循环的第一个数字,表明样品中存在特定的病原体。CT值越低,被测样品中的病原体含量越高。必须谨慎地解释非常高的CT值,因其可能来自Taqman探针在晚期的自发降解,尽管样品中缺乏靶向DNA。
对PCR结果的解释看似简单。兽医从业人员必须认识到该方法的一些局限性,并能够批判性地解释其结果。如PCR的阳性结果证明样本中存在目标核酸(如PRRSV)。但不能证明样品中含有传染性病毒。实时PCR可对样本中的病毒进行定量。其结果表示为“阈值循环数”(CT)。它是PCR仪器检测反应管荧光发射的第一个循环数。循环数越低,靶向DNA的拷贝数越高(读作病毒拷贝数)。如,具有CT20的样本可被认为是高度阳性的,具有CT 35的样本是低阳性的。然而,在某些情况下,仅在实时PCR晚期循环中检测到荧光,例如>38。 如何解释这么高的值?这种结果并不总是表明样本中存在非常少的病毒拷贝。所谓的“后期上升”可能是在许多PCR热循环后,探针自发降解的结果,这类似于由DNA聚合酶引起的酶促核溶解。因此,在样品中没有病毒核酸的情况下也可能发生。在监测无PRRSV猪群的同时,正确解释“后期上升”非常重要。必须进行后续诊断,如酶联免疫吸附试验。但欧洲的一些诊断实验室没有向客户提供实时PCR的精确CT值。期结果仅表示为负或正。这些报告对猪场的实用性有限,在某些情况下还可能导致其制定错误的PRRSV控制方案。
实际问题
- 目前的PCR方法均不能检测所有PRRS病毒。
- 从一个猪场随机抽取的几份样本的PCR结果呈阴性,不能证明无PRRSV感染。
- PCR的阳性结果证明样品中存在PRRSV核酸,但不一定证实其传染性。



