简介
该猪场是爱尔兰一家商品猪场,母猪存栏600头,一年内增加至1000头母猪。

表1说明了疫苗接种方案。
表1疫苗接种程序
| 疫苗 | 后备母猪 | 母猪 | 公猪 | 仔猪 |
| 细小病毒 | 选种时注射2毫升 | 分娩后2周注射2毫升 | 每年2次每次注射2毫升 | |
| 猪丹毒 | 选种时和配种前2周分别注射2毫升 | 分娩后2周注射2毫升 | 每年2次每次注射2毫升 | |
| 大肠杆菌和梭状芽孢杆菌 | 分娩前6周和2周注射2毫升 | 分娩前2周注射2毫升 | ||
| 蓝耳病毒 | 选种时和配种后60天分别注射2毫升 | 配种后60天和分娩后6天分别注射2毫升 | 每年2次每次注射2毫升 | |
| 圆环病毒2型 | 断奶时注射1毫升 | |||
| 地方性肺炎 | 10-14日龄和断奶时分别注射1毫升 |
后备母猪来自猪场内部。用公猪催情。后备母猪和母猪用同一来源精子进行人工授精。
最近的猪舍在2公里外
历史
猪农与兽医联系,猪场出现呼吸困难增加及体况下降,断奶和生长猪死亡率增加。
调查
临床调查
在2017年9月的一次猪场访问中,有许多6-15周龄的猪出现体况下降和腹部气喘的临床症状(图1和图2)。少见咳嗽。猪栏养殖密度过大。

图1.断奶仔猪养殖密度过大,其中一些动物出现体况下降的临床症状。

图2. 动物出现体况下降的临床症状。
当问猪农时得知,从断奶到育成的死亡率在3.5-5%之间。但死亡率与餐厅墙上记录的周死亡率完全不同(图3)。
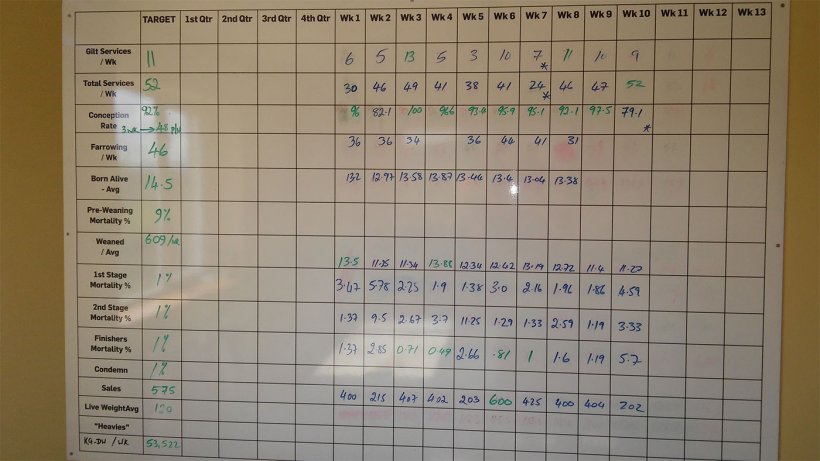
图3.至2017年9月猪舍的周生产性能。
分析墙上的数据可见过去10周内从断奶到育成的死亡率为8.48%。第一阶段(4至9周龄)的死亡率为2.64%; 第二阶段(10至15周龄)为3.82%;育成猪(从16周龄到屠宰)为1.83%。
实验室调查
将2头出现腹部气喘和体况下降的6周龄断奶仔猪实施安乐死以进行尸检(图4和视频1)。采集样品并提交给实验室进行分析。

图4:出现腹部气喘和体况下降的断奶仔猪
视频1:出现腹部气喘和体况下降的6周龄断奶仔猪
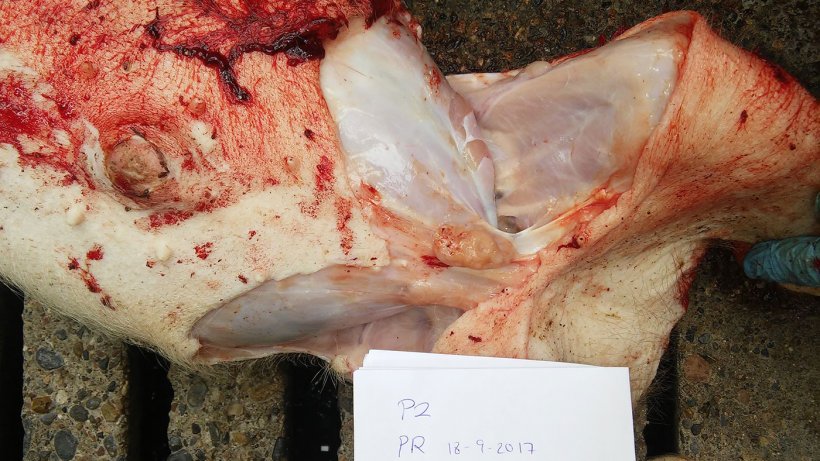
表2总结了尸检和实验室检查的结果。尸检照片见图5,6,7和8。
表2:2头6周龄断奶仔猪的实验室结果。
| 断奶仔猪 | 死后尸检 | 细菌学结果 | 生物分子学结果 | 组织学 |
| 1 |
身体状况不佳。 偏瘦 心包炎。 胸膜炎,心脏和隔叶腹侧区域的肺实变伴有间质性肺炎 |
出血败血性巴斯德氏菌(肺) 猪链球菌血清型3(肺) |
通过RT-PCR检测到猪肺炎支原体,A型流感病毒和PCV-2型阴性(肺) 断奶仔猪1和2的肺部,通过RT-PCR检测到蓝耳病欧洲型阳性(CT: 21.2) |
支气管中含有中性粒细胞和支气管上皮增生。 肺组织表现出纤维性支气管肺炎的不同状态。 故经常检测到肝样变和肉质化。 在小叶间和肺泡间隙存在多处纤维组织增生 这些发现是慢性炎症的代表。 |
| 2 |
体况差 偏瘦 腹股沟淋巴结增大 心包炎,胸膜炎。 心脏和隔叶腹侧区域的肺实变伴有间质性肺炎 |
出血败血性巴斯德氏菌(肺) | 通过RT-PCR检测到猪肺炎支原体,A型流感病毒和PCV-2型阴性(肺) 断奶仔猪1和2的肺部,通过RT-PCR检测到蓝耳病欧洲型阳性(CT: 21.2) |
肺部有慢性炎症的迹象。 炎症更多是一种卡他化脓性类型。 支气管充满中性粒细胞,支气管上皮增生。 慢性的特征在于间质间隙纤维组织的增生。 胸膜局部增生并可检测到间质水肿。 |
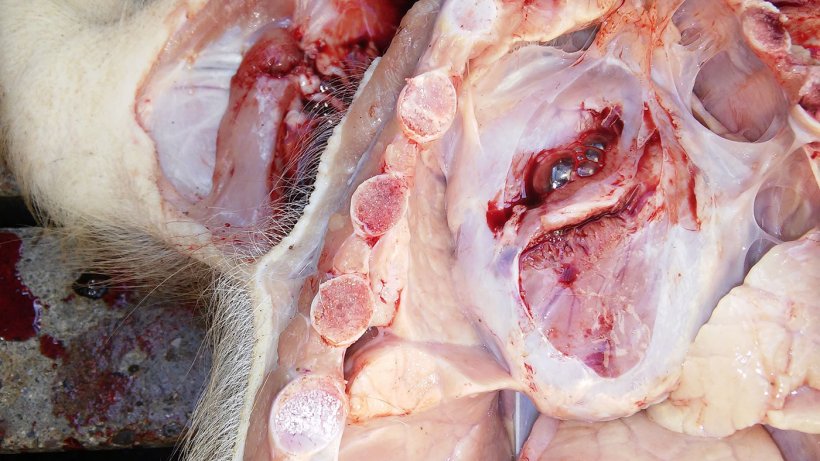
图5.心包炎。
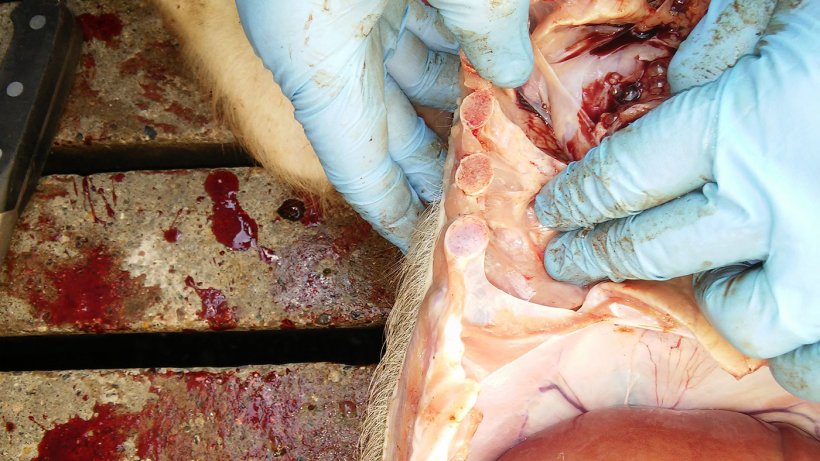
图6.肺胸膜和胸廓胸膜间的胸膜炎。

图7.间质性肺炎伴有腹侧膈叶的明显肺实变。
鉴别诊断
基于临床和实验室调查,制定了以下的鉴别诊断:
- PRRS(猪繁殖与呼吸综合征)
- PCV2(猪圆环病毒2型)。
- A型流感病毒
- 流行性肺炎(猪肺炎支原体)
在实验室结果为阴性的基础上排除了甲型流感病毒和PCV-2。 本猪舍针对PCV-2的疫苗接种程序令人满意。
鉴于实验室结果阴性,疫苗接种程序令人满意,且在畜群中未见咳嗽,排除了流行性肺炎。
基于历史及一致的临床和实验室调查结果,作出畜群感染PRRS并伴有机会性细菌的二次感染的诊断。
控制程序
建议对所有10-14日龄的仔猪接种MLV-PRRS疫苗。
控制程序的结果
呼吸困难和体况不佳的猪减少了。三个月后,死亡率大幅下降至5.2%。第一阶段(4至9周龄)的死亡率为2.25%; 第二阶段(10至15周龄)为1.72%; 育成猪(从16周龄到屠宰)为1.24%(图10)。未改变饲养密度。

图10.直到2018年2月为止的猪舍周生产性能。
讨论
20世纪80年代后期,美国出现了严重的生殖和呼吸系统疾病(Keffaber,1989)。当时病原体未知。1990年在德国报道了同样的综合征(OIE,1992)。该病原体于1991年首次在荷兰分离(Wensvoort等,1991),并命名为猪繁殖与呼吸综合征(PRRS)(Terpstra等,1991)。
PRRS感染在1997年首次在北爱尔兰(Anonymous,1997),1999年在爱尔兰共和国被诊断(Ohlinger等,2000)。
世界上大多数生猪生产国都存在PRRS,仅有少数例外。如瑞典(Carlsson等2009),挪威(OIE 1997),芬兰(Bøtner2003),瑞士(Corbellini等2006),新喀里多尼亚(OIE 1996),新西兰(Motha等1997),澳大利亚(Garner和其他人 1997年),阿根廷(Perfumo和Sanguinetti 2003),巴西(Ciacci-Zanella等2004)和古巴(Alfonso和Frias Lepoureau 2003)都报告没有PRRS。
PRRS感染的严重程度因猪舍而异。非传染性因素加剧了临床症状的表达。这些非传染性因素包括管理,猪生产流,猪舍和温度调节(Zimmerman等2012)。一些病毒和细菌的同时感染增强或增加了PRRS临床症状表达的严重性(Shibata等,2003,Thacker等,1999,Borobia等,2014)。 胸膜炎是PRRS感染动物的肺部病变之一(Muirhead 和Alexander 1997)。BPEX(2009)发现胸膜炎造成的经济影响很大。胸膜炎患病率增加与屠宰体重减轻及屠宰日龄增加有关。对于生产者来说,在批次水平上,典型的10%胸膜炎患病率表明每头猪2.26英镑 - 基于减少的胴体重和屠宰年龄的增加
已证明MLV PRRS疫苗有限制野毒对断奶仔猪的效果(Waddell等,2008),正如本临床案例所述。




