众所周知,猪的免疫系统在控制猪圆环病毒Ⅱ型的感染起着重要的作用。大多数情况下,该病毒能被控制在亚临床感染状态。然而,一个猪场内不同比例的猪可能会由此发展成断奶仔猪多系统衰竭综合征(PMWS),这是一种由多病因引发的获得性免疫缺陷综合征。遗憾的是,猪发展成亚临床感染状态或是PMWS的确切免疫学机制仍不为人知。
即使在相关知识缺乏的背景下,还是成功开发了猪圆环病毒疫苗。事实上,目前的商用疫苗能有效地控制PMWS,甚至能够降低亚临床感染造成的影响。不论是生长猪接种PCV2疫苗,还是生长猪来自接种疫苗的母猪都可以见到明显减缓的生产性能下降趋势。因此,猪场免疫疫苗后的益处包括平均日增重和饲料转化率提高、死亡率下降和药物治疗成本减少等。
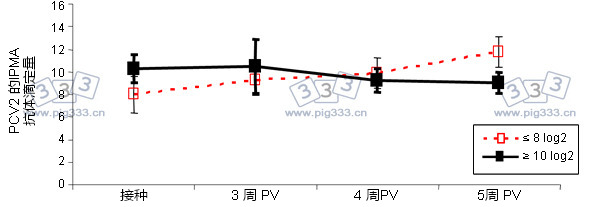
图1. 免疫后3、4、5周猪群体内PCV2 IPMA抗体滴度(仔猪3周龄时免疫)。根据仔猪免疫时的抗体滴度,将仔猪分成IPMA抗体滴度≤8 log2 和IPMA抗体滴度≥10 log2两组(Fort et al., 2009, Vaccine, 27: 4031–4037).
人们一般认为,不论抗体是被动获得(母猪接种疫苗)还是主动诱导产生(仔猪接种疫苗)的,疫苗的有效性依赖于抗PCV2抗体的保护作用。当然,疫苗要产生充分的免疫效果,细胞免疫显然是一个必要条件。同样值得提及的是,在实验条件下,高水平母源抗体可能干扰疫苗免疫后的血清转化过程(图1)。具体而言,研究表明,接种疫苗后,IPMA(免疫过氧化物酶单层细胞试验)抗体滴度超过10Log2会对体液免疫应答产生影响。因此,母源抗体是否干扰免疫应答取决于仔猪接种疫苗时体内抗体滴度。而众所周知,仔猪体内母源抗体的滴度依赖于母猪的抗体滴度,因此一个猪群内每个仔猪的PCV2母源抗体滴度不尽相同。此外,研究还证实,在实验条件下,一部分仔猪受到PCV2攻毒后但不会感染,这是由于它们体内含有母源抗体。因此,母源抗体可以影响抗感染和接种疫苗后的血清转化过程。
因此,母源抗体是否会影响免疫PCV2疫苗的猪群的生产性能尚有争议。有报道指出,疫苗会排除母源抗体的干扰,因为它们能够防止猪群出现PMWS,并提高猪群的生产性能。然而,目前所有市售疫苗要面对的一个问题是要排除母源免疫的干扰;另一个问题是大部分市售疫苗在接种后是否能够在母源抗体存在的情况下独自产生抗体滴度。从生物学的角度来看,猪群的血清学参数倾向于正态分布图(图2)。在这种情况下,处于正态分布曲线边缘的那些猪的抗体滴度最高,受母源抗体干扰的风险可能较高。从科学的角度来看,这一风险已经被降至最低程度,很可能因为疫苗已证实有极好的免疫效果。然而,在过去几年中过度使用此类疫苗,并且预期在未来也会如此,这种情况将增加疫苗免疫出现失败的潜在可能性。大多数免疫失败事故最有可能是人为因素(疫苗保存和应用等)引起的,而不是疫苗效价问题。因此,有必要调查清楚这些疫苗失败事件,PCV2疫苗的接种年龄也是要研究的问题之一。
根据猪群的抗体滴度和感染动力学,接种窗(理想的疫苗接种时间)以理论形式被提出。按照定义,接种窗的的本质是抗体滴度范围,在接种窗的抗体滴度范围内免疫动物,既能减少母源抗体干扰,又在感染前产生保护性免疫应答。显然,这种方法只是基于一个猪场,但抗体滴度上的差异不仅存在于个体之间,而且还可能存在于猪场之间。因此,如果我们不考虑每个猪群的特殊性而确定接种疫苗的年龄,这样接种疫苗能获得最好效果吗?

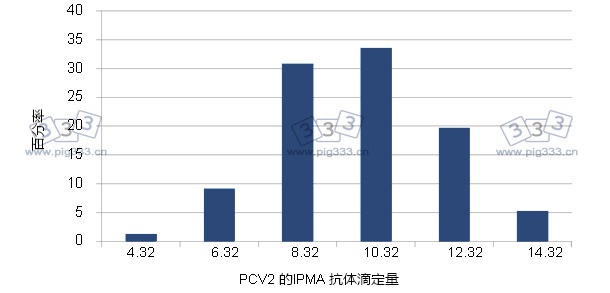
图2. 152只断奶仔猪的PCV2 IPMA 抗体滴度分布图. 抗体滴度呈正态分布.


