文章:
在试验条件下检测猪唾液中的猪繁殖与呼吸综合征病毒。John Prickett, Robert Simer, Jane Christopher-Hennings, Kyoung-Jin Yoon, Richard B. Evans and Jeffrey J. Zimmerman. J VET Diagn Invest 2008 20: 156 DOI: 10.1177/104063870802000203

文章简介:
文章研究的内容是什么?
本研究的目的是:确定猪唾液中(OF)是否存在PRRSV 或PRRSV抗体,PRRSV 或PRRSV抗体在唾液中的存活时间,及猪龄对其的影响。
试验如何进行?
选取48头未感染 PRRSV的猪,按周龄分成3组:4、8和12周龄。每组16头猪,其中12头在0日龄肌肉注射PRRSV,其余 4头作对照。接种PRRSV病毒后(接种后0-63天),收集猪的血清、口腔拭子和唾液,进行qRT-PCR 、ELISA和 IFAT分析。
接种病毒后0-61天,收集每个猪栏(4或6头猪)的唾液样品,每周两次。每个猪栏都挂一根棉线。
试验结果是什么?
在猪血清和OF中都检测到PRRSV。猪龄对唾液中的病毒量或病毒存活时间没有影响(表1是qRT-PCR的检测结果)。ELISA 和 IFAT检测到病毒抗体,但抗体水平很低。
表1.实时qRT-PCR检测唾液、血清和口腔拭子的分类结果
| 猪栏结果 | 个体结果 | ||||
| 猪栏唾液样品 | 血清 | 血清 | 口腔拭子 | ||
| 周 | 试验 A | 试验 B | 试验 A | 试验 A | 试验 A |
| 1 | 8 (100%) | 8 (100%) | 8 (100%) | 35 (97%) | 7 (20%) |
| 2 | 7 (88%) | 8 (100%) | 8 (100%) | 36 (100%) | 3 (8%) |
| 3 | 6 (75%) | 4 (50%) | 8 (100%) | 32 (89%) | 2 (6%) |
| 4 | 7 (88%) | 6 (75%) | 7 (88%) | 18 (50%) | N/A |
| 5 | 2 (25%) | 3 (38%) | 6 (75%) | 10 (28%) | N/A |
| 6 | 0 | 3 (38%) | 6 (75%) | 12 (33%) | N/A |
| 7 | 1 (13%) | 1 (13%) | 5 (63%) | 7 (19%) | N/A |
| 9 | 0 | 0 | 3 (38%) | 5 (14%) | N/A |
下图是接种病毒后几周,qRT-PCR检测猪血清和OF中PRRSV的结果,结果表明:在PRRSV检测中,血清和唾液的相关性很高。
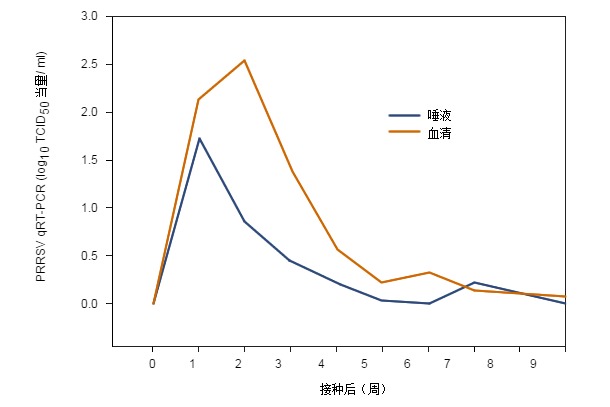
图1.接种后几周血清和唾液qRT-PCR检测结果
本文的结论是什么?
兽医很少使用唾液诊断。但是本实验的结果表明:在猪群中,采集猪栏内的唾液是检测PRRSV的一种简单、实用、成本低廉的方法。
用qRT-PCR检测唾液样品中PRRSV大约需要4周。
|
在PRRS阳性猪场很难控制该病毒。虽然我们有疫苗,但它有一定的效用范围,因此不能只靠疫苗控制病毒。正确管理(其中最重要的是严格的批次管理)后备母猪是控制PRRS的关键因素,但这所有的措施都是防止病毒在猪场内部传播。 如何确保措施实施后的效果和我们预期的一样呢?虽然检测唾液中PRRS病毒及其抗体对于控制猪场疾病的作用很大,但是通过唾液分析一头猪的PRRS状况是不可能(我们分析的是一个猪栏内的猪),在猪生产中,当我们要建立一个种群的动态感染时,这是很有用的。原因是一个结果代表多个样品的结果。并且该方法中猪的数量大,采样容易,检测频率高,结果代表性高。 那什么时候使用OF诊断合适呢?为了确保在分娩季引入后备母猪前,它们已形成抗病毒性(ELISA-positive),能够克服病毒血症(PCR-negative),可以在替补时设置控制点,即在引入后备母猪时或引入后备母猪后。也可以在不同的生产批次设控制点。在猪场,PRRSV感染不是静态的,我们的活动能产生积极的效果,改变感染动力学。例如,采用严格的控制措施,越推后病毒感染,控制间接感染(来自上一批次)就越重要。本文中的唾液诊断要求我们增加控制的频率,控制亚种群风险,如猪场常发生的生长速率低。 |





